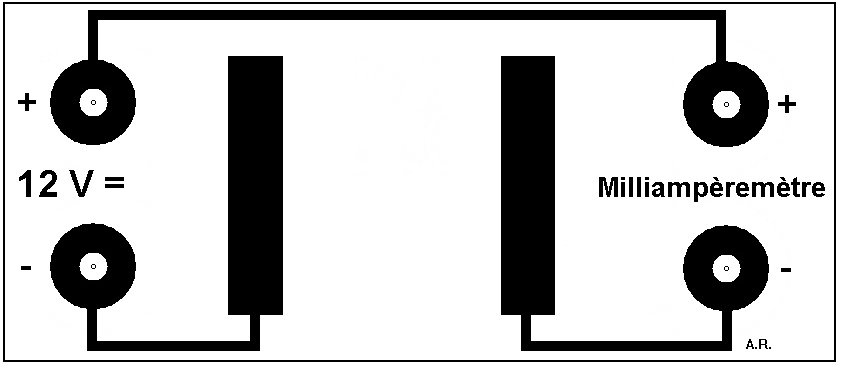
Migration des ions
Imprimez le circuit ci-dessous sur transparent en réglant l'échelle d'impression de telle sorte que la distance entre les deux électrodes soit de 3 cm.
Gravez le circuit. Décapez uniquement les électrodes centrales.

Percez les 4 trous pour les bornes de liaison (qui serviront aussi de pieds). Soudez les 4 bornes.
Vernissez le circuit (vernis à ongles incolore par exemple), à l'exception des électrodes. Votre montage est prêt.

Utilisation :
Etalez entre et sur les électrodes un gel opaque blanc ionique (un quart de portion de fromage fondu).

Reliez le circuit à une alimentation 12 V = et à un milliampèremètre (calibre 200 mA).

Placez au centre de cette couche une petite goutte d'un mélange ionique (un ion positif et un ion négatif colorés).
Observez (durée environ 20 min).
![]()


Début Fin
Mélange ionique utilisable :
Sulfate de Cuivre + Dichromate de Potassium
Sulfate de Cuivre et Permanganate de potassium
Variante :
Fabriquez le circuit ci-dessous :
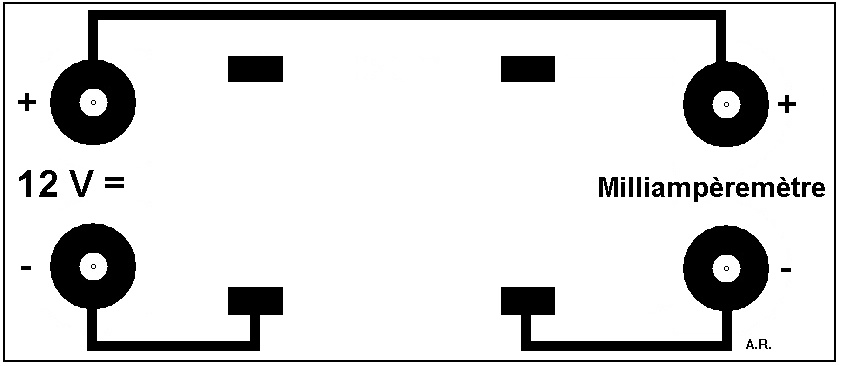
Soudez deux électrodes métalliques au circuit, en variant la nature des métaux utilisés d'un montage à l'autre.

Vous pourrez, comme avec le montage précédent, montrer la migration des ions mais de plus vous verrez apparaître au niveau de l'anode des ions métalliques correspondant au métal de cette électrode, donc de couleur différente d'un montage à l'autre. Cela permet de faire remarquer aux élèves qu'au delà de la migration des ions, il se passe bien d'autres choses, et en particulier des réactions chimiques de formation d'ions à partir du métal, lors de l'expérience.

Avec des électrodes en acier, les ions fer produits migrent en formant une bande bien nette, ce qui permet d'évaluer la vitesse de migration (de l'ordre du cm/h dans le fromage fondu avec un champ électrique de 4 V/cm).
